Содржина
Во неорганска хемија, се зборува за а Сол кога се повикуваме на соединенија кои се добиваат кога киселината ги има атомите на водород заменети со основни радикали, што во конкретниот случај на кисели соли, се од негативен тип (катјони). По тоа што се разликуваат од неутрални соли или бинарни соли.
Соли обично се формираат преку реакција помеѓу киселина и хидроксид (база)На Во овие реакции, нормално базата ги губи своите хидроксилни групи (-OH) и киселината водородните атоми (H), формирајќи неутрална сол; но ако дотичната киселина зачува еден од нејзините атоми на водород, менувајќи го електричниот полнеж на реакцијата, ќе добиеме кисела сол или хидрогенизирана сол.
Така, на пример, литиум бикарбонат се добива од литиум хидроксид и јаглеродна киселина:
LiOH + H2CO3 = Ли (HCO3) + Н2ИЛИ
Реакцијата, како што ќе се види, исто така фрла вода како нуспроизвод.
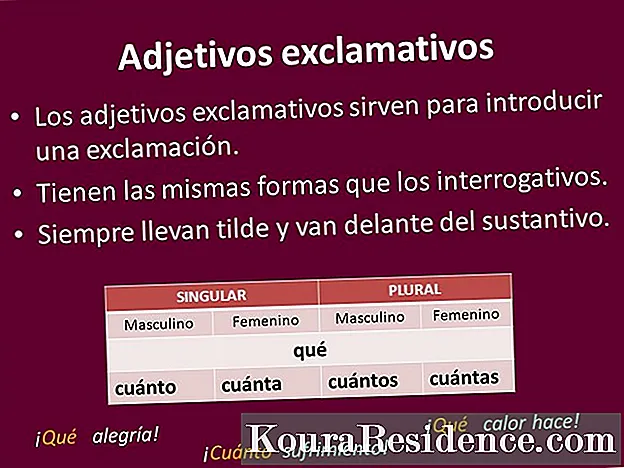
Номенклатура на кисели соли
Според функционалната номенклатура, за кисели соли традиционалниот начин за именување на неутрални соли треба да се користи од наставките -ate или -ite, но претходеше со префикс што го означува бројот на атоми на водород што биле заменети на молекулаНа Така, на пример, литиум бикарбонат (LiHCO3) ќе има два атоми на водород (би = два).
Од друга страна, според системската номенклатура, терминот водород на вообичаеното име на добиената сол, почитувајќи ги префиксите што се однесуваат на заменети атоми на водородНа Така, литиум хидроген карбонат или литиум хидроген карбонат ќе бидат начини за именување на истиот литиум бикарбонат (LiHCO3).
Примери за кисели соли
- Натриум бикарбонат (NaHCO3). Исто така наречен натриум хидроген карбонат (IV), тоа е бела кристална цврста, растворлива во вода, која може да се најде во природата во минерална состојба или може да се произведе во лабораторија. Тоа е една од најпознатите кисели соли познати и е широко користена во кондиторски производи, фармакологија или јогурт.
- Литиум бикарбонат (LiHCO3)На Оваа киселина сол се користи како средство за апсење на CO2 во ситуации кога таков гас е непожелен, како во вселенските мисии „Аполо“ во Северна Америка.
- Калиум дихидроген фосфат (KH2ПО4). Кристално цврсто, без мирис, растворливо во вода, широко се користи во различни индустрии како што се храна квасец, хелатно средство, хранлив засилувач и асистент во процесите на ферментација.
- Натриум бисулфат (NaHSO)4). Кисела сол формирана со неутрализација на сулфурна киселина, широко се користи индустриски во рафинирање на метали, производи за чистење и иако е многу токсична за некои ехинодерми, се користи како додаток во храна за миленичиња и во производство на накит.
- Натриум водород сулфид (NaHS). Опасно соединение за деликатно ракување, бидејќи е многу корозивно и токсично. Може да предизвика сериозни изгореници на кожата и оштетување на очите, бидејќи е и запалив.
- Калциум хидроген фосфат (CaHPO4). Се користи како додаток во исхраната во житарици и добиточна храна, тој е цврст нерастворлив во вода, но способен за кристализација кога се хидрира со конзумирање на две молекули вода.
- Амониум хидроген карбонат ([NH4] HCO3). Познат е како амониум бикарбонат и се користи во прехранбената индустрија како хемиски квасец, иако има недостаток да зароби амонијак, давајќи лош вкус на храната доколку се користи прекумерно. Исто така се користи во апарати за гаснење пожар, производство на пигменти и како гумен експандер.
- Бариум бикарбонат (Ba [HCO3]2). Кисела сол која кога се загрева може да ја поништи својата реакција на производство и е многу нестабилна освен во раствор. Широко се користи во керамичката индустрија.
- Натриум бисулфит (NaHSO3). Оваа сол е крајно нестабилна и во присуство на кислород се претвора во натриум сулфат, поради што се користи во прехранбената индустрија како конзерванс и средство за сушење. Тоа е екстремно средство за намалување и најчесто се користи од страна на човекот, исто така се користи за одредување бои.
- Калциум цитрат (Ca3[В6Х5ИЛИ7]2). Најпозната како горчлива сол, се користи како конзерванс за храна и како додаток во исхраната кога е поврзан со аминокиселината лизинНа Тоа е бел, без мирис, кристален прав.
- Монокалциум фосфат(Ca [Н2ПО4]2). Безбојна цврста материја што се добива од реакцијата на калциум хидроксид и фосфорна киселина, Широко се користи како средство за квасување или како ѓубриво во земјоделски работи.
- Дикалциум фосфат (CaHPO)4). Исто така познат како калциум монохидроген фосфат, има три различни кристални форми кои Се користат како додаток во храната и го има во пастите за забиНа Покрај тоа, природно се формира во камења во бубрезите и таканаречениот стоматолошки „камен“.
- Мономагнезиум фосфат (MgH)4П2ИЛИ8)На Се користи како киселина, коректор на киселост или средство за третман на брашно, тоа е кристално бела сол без мирис, делумно растворлива во вода и се користи за зачувување на храната.
- Натриум диацетат (NaH [С2Х3ИЛИ2]2). Оваа сол се користи како средство за арома и конзерванс за оброци, спречувајќи или одложувајќи појава на габи и микробактерии, како во вакуумски спакувани производи, како што се месни производи, така и во индустријата за брашно.
- Калциум бикарбонат (Ca [HCO3]2). Хидрогенизирана сол која потекнува од калциум карбонат, присутна во минерали како варовник, мермер и други. Оваа реакција подразбира присуство на вода и СО2, па може да се појави спонтано во пештери и пештери богати со калциум.
- Флуорид на рубидиум киселина (RbHF). Оваа сол се добива од реакцијата на хидрофлуорова киселина (водород и флуор X) и Рубидиум, алкален метал. Резултатот е токсично и корозивно соединение со кое мора да се постапува со претпазливост..
- Моноамониум фосфат ([NH4] Н2ПО4). Растворлива во вода сол, произведена од реакција на амонијак и фосфорна киселина, нашироко се користи како ѓубриво бидејќи ја обезбедува почвата со азот и фосфор хранливи материи неопходни за раст на растенијатаНа Исто така е дел од прашокот ABC во апаратите за гаснење пожар.
- Цинк хидроген ортоборат(Zn [HBO3])На Солта се користи како антисептик и како додаток во производството на керамика.
- Мононатриум фосфат (NaH2ПО4). Се користи најчесто во лаборатории, како што се „тампон”Или тампон раствор, кој спречува ненадејни промени во pH вредноста на растворот.
- Калиум хидроген фталат (KHP)На Исто така наречен калиум киселина фталат, тоа е цврста и стабилна сол во обичниот воздух, така често се користи како примарен стандард во мерењата на pH вредностНа Исто така е корисно како тампон агент во хемиски реакции.
Може да ви послужи:
- Примери за минерални соли и нивната функција
- Примери за неутрални соли
- Примери за соли на Оксисалес